Aplicaciones de los plasmas en la salud
Responsable: REGULO LOPEZ CALLEJAS
Objetivos:
Realizar investigación teórica y experimental sobre diversas aplicaciones médicas de los plasmas de aguja y/o de descarga de barrera dieléctrica
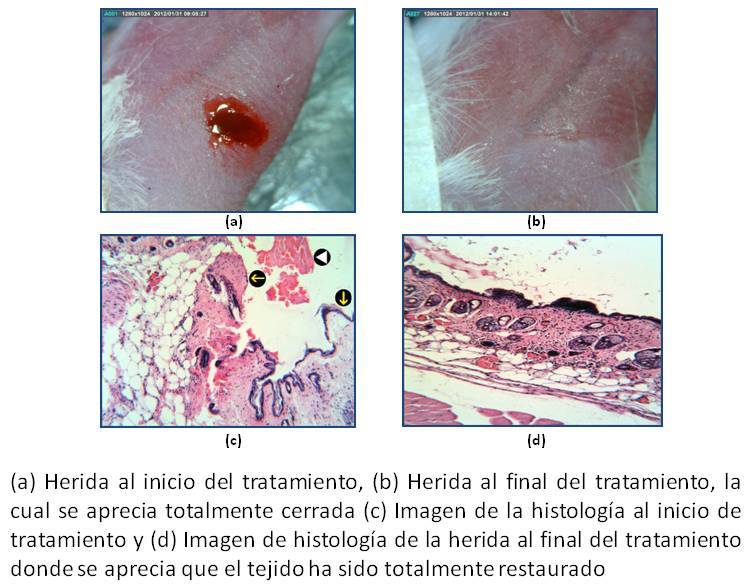
Antecedentes:
En medicina y biología la palabra “plasma” se refiere al componente líquido no celular de la sangre, mientras que en física la misma palabra se refiere al cuarto estado de la materia. Para evitar confusiones en el uso de la misma palabra en el desarrollo del documento aquí presentado, usaremos “plasma” cuando se trate lo relacionado a la física y química, y “plasma sanguíneo” en lo relativo a la sangre. Un plasma es un gas parcialmente ionizado, que contiene portadores de carga libres (iones y electrones), radicales activos y moléculas excitadas. El plasma se produce en el laboratorio a muy variadas presiones, dependiendo la aplicación tecnológica requerida. A bajas presiones, se obtienen plasmas de alta temperatura relevantes para los procesos de fusión donde Te≈Ti≈Tg, (Te = temperatura electrónica, Ti = Temperatura Ionica y Tg= Temperatura del Gas) la temperatura promedio es del orden de 106-108 °K y la densidad de los electrones es igual o mayor a 1020 m-3. Plasmas producidos a presión atmosférica presentan baja temperatura y se subdividen en plasmas térmicos (en cuasiequilibrio) y fuera de equilibrio o no-térmicos. En el caso de los primeros, se tiene que Te≈Ti≈Tg ≤2×104 °K y que la densidad de los electrones es igual o mayor a 1020 m-3. Para los plasmas fuera de equilibrio, Te>>Ti≈Tg=300 a 103 °K y la densidad de los electrones se aproxima a 1010 m-3. Estos últimos son de interés particular debido a sus relativamente bajas temperaturas que trabajan que no causan daño térmico.
Los plasmas no-térmicos han sido aplicados en las últimas dos décadas a la tecnología de materiales. Las tendencias actuales de este tipo de plasmas se centran en aplicaciones a la tecnología de la salud y en particular al tratamiento no destructivo del tejido vivo, lo cual se logra controlando la aplicación del plasma en zonas específicamente dañadas. Por otra parte, los plasmas no-térmicos permiten la inactivación de bacterias de una manera rápida y radical, motivo por el cual son ideales para la esterilización de instrumentos quirúrgicos y la desinfección de tejidos. Sin embargo, un gran esfuerzo de investigación debe llevarse a cabo antes de que estas técnicas se conviertan en una práctica común en la medicina. Se espera que con el proyecto aquí presentado se obtenga una aportación tanto al área de la medicina dental como a la dermatología de la desinfección, cauterización y cicatrización.
Plasmas no-térmicos. En los plasmas fuera de equilibrio, o no-térmicos, la compleja química está sostenida por los electrones. Ellos llevan a cabo la ionización necesaria para sostener el plasma; además, son responsables de la excitación atómica/molecular, la disociación y la producción de especies. Cuando las partículas cargadas son minoritarias, el calentamiento de las moléculas neutras es limitado. Así, el plasma no-térmico se difunde y la fracción de especies ionizadas es inferior al 0.1%. Los plasmas no-térmicos a presión atmosférica pueden crearse utilizando uno o más de los siguientes principios:
-
Plasmas transitorios. La frecuencia de transferencia de energía en las colisiones entre electrones y el gas está dada por: ν[s-1]=(me/ma)2naσeaυe donde me/ma es la relación entre la masa de los electrones y la masa de los átomos (moléculas), na es la densidad de átomos, σea es la sección transversal de colisión y υe es la velocidad de los electrones. En los plasmas a presión atmosférica la densidad de partículas (n) es aproximadamente 108 colisiones/s. Al menos 100-1000 colisiones son necesarias para un eficiente calentamiento del gas. Por tanto, si la duración de plasma es menor que 10-6-10-5 s, el calentamiento del gas es limitado. Por supuesto, para propósitos prácticos, tal plasma debe ser operado en un modo repetitivo, por ejemplo, trenes de pulsos con duración de microsegundos deben repetirse a intervalos de milisegundos [Ro-2008b].
- Micro-Plasmas [St-2002], en éstos el calentamiento del gas que se produce en el volumen del plasma, la energía es transportada al exterior por difusión/convección térmica. Si el plasma tiene un pequeño volumen y una superficie relativamente grande, el calentamiento del gas es limitado.
- Descarga de barrera dieléctrica (DBD) [La-2002, Ra-2003], estos plasmas se crean normalmente entre placas metálicas paralelas que están aisladas por una capa de material dieléctrico. Son usualmente generados por una corriente eléctrica con una frecuencia en el rango de los kHz. También es posible obtener una DBD mediante una simple transformación de tensión en la red de alimentación de CFE (60 Hz/110 V) a aproximadamente 1 kV. Las DBDs tienen, por lo general, bajos grados de ionización y corrientes en el orden de los mA. Además, las placas de los electrodos son del orden de los cm2 y la separación entre ellos es del orden de los milímetros. La gran proporción de superficie a volumen en una DBD promueve las pérdidas por difusión y mantiene una temperatura baja del gas, pocas decenas de grados por encima de la temperatura ambiente. Esto es un inconveniente de una DBD pues su flexibilidad es limitada. Como la distancia entre las placas es muy pequeña, el tratamiento de muestras grandes e irregulares no es fácil de llevar a cabo e incluso se podría decir que es prácticamente imposible.
La capacidad del plasma en el tratamiento de células vivas, tejidos y órganos, ha permitido en la última década la investigación y el desarrollo tecnológico en biotecnología, microbiología y medicina. Esta nueva y fascinante línea de estudio presenta numerosos retos tecnológicos y cuestionamientos fundamentales sobre los mecanismos de interacción entre el plasma y los organismos vivos. En particular, las aplicaciones biomédicas de los plasmas, han estado enfocadas principalmente a la esterilización de superficies [St-2004], el tratamiento superficial para controlar la compatibilidad con biomateriales, [Cr-2010] la esterilización y curación de heridas [Mo-2001], coagulación de sangre [Ka-2000], tratamiento de piel [Ki-2007, He-2010], esterilización de material reutilizable sensible al calor [Sh-2010, Ke-2010].
En el campo de la odontología, la preparación de las cavidades dentales a través de medios mecánicos permite la remoción de material dañado. El calentamiento por fricción de la pieza dental y la vibración provocados por el uso del taladro convencional producen un intenso dolor al paciente, además de destruir tejido sano que debe ser removido para asegurar que la cavidad dental esté libre de bacterias. La pieza dental queda estructuralmente más débil y propensa a fracturas. Eva Stoffels [St-2002] introdujo en el año 2002 el concepto de un reactor de aguja de plasma adaptado al tratamiento alternativo de las cavidades dentales antes de ser obturadas. La idea cobró gran interés debido a que la aguja de plasma tiene el propósito de inactivar las bacterias de la placa dento-bacteriana y detener la caries por medio del uso de un micro-plasma frío a presión atmosférica. El tratamiento no provoca ni el calentamiento de la pieza, ni el deterioro de material sano: dos ventajas que, hasta ese momento, sólo el tratamiento por láser podía ofrecer. Se han hecho experimentos en años recientes enfocados a la caracterización del plasma producido en la aguja de plasma, su utilidad para la aniquilación de diferentes bacterias, el tiempo óptimo de tratamiento y los efectos de la temperatura con el cambio en el flujo de gas [St-2006], entre otros, sin que hasta la fecha se cuente con un equipo de aplicación en pacientes directamente en los consultorios.
Con base en lo anterior, en el proyecto aquí propuesto se propone llevar a cabo la investigación teórica-experimental en el campo de la tecnología médica en: a) tratamiento de caries dentales y b) desinfección, cauterización y cicatrización de la piel.
Caries dental. Una de las afecciones más inherentes a la humanidad es la caries dental, debido a la frecuencia de su aparición: una enfermedad crucial en la odontología [Me-1986], “Carie” proviene de la palabra latina que significa putrefacción, degradación o podredumbre. Suele aparecer en los niños y en los adultos jóvenes, pero pueden afectar a cualquier persona y es la causa más importante de la pérdida de los dientes [As-2003]. Existe un cierto número de teorías acerca de la etiología de la caries, pero la mayoría de las pruebas disponibles apoyan la teoría acidogénica. Ésta atribuye la causa de la caries a los ácidos producidos por los microorganismos en la boca, al fermentar los carbohidratos de la dieta en dos etapas: descalcificación de los tejidos y disolución de los residuos reblandecidos [Wo-1996].
El desarrollo de la caries requiere que las bacterias sean acidófilas, acidógenas y que puedan ser medios para contener ácidos metabólicos. La gran mayoría de las bacterias de la placa no están involucradas en el proceso de caries. Sin embargo, existe especial interés en el Streptococcus Mutans (SM) dado que algunos estudios muestran claramente que existe una fuerte correlación entre éste y la caries dental [Sl-2006]. El SM coloniza las superficies lisas y fisuras de los dientes cuando el intervalo de temperatura bucal es de 303.15°K a 320.15°K (30°C a 47°C) [Ne-1994].
Células y tejido. Los tejidos patológicos humanos son materiales complejos que normalmente constan de varios tipos de células con una comunicación de matriz extracelular (ECM). La aplicación directa del plasma a los tejidos de cualquier tipo conducirá a complicadas cadenas de reacciones. Para fines de la presente investigación, por lo tanto, se iniciará con el estudio de las células.
Células. En el desarrollo del proyecto se trabajará con animales de laboratorio, específicamente con ratones cuyas células típicas tienen un diámetro entre 10 a 20 μm, están rodeadas por una membrana que las protege del entorno exterior y están constituidas por moléculas de fosfolípidos [Al-1994]. El núcleo de la célula contiene ADN con la información genética. La célula se compone de partes tales como el citoesqueleto para la estructura y las mitocondrias para la conversión de energía. Hay dos tipos de muerte de la célula: necrosis y apoptosis:
- La necrosis o muerte accidental de la célula es la consecuencia de una lesión irreversible en los mecanismos que mantienen la integridad de la célula. En las células necrosadas, la membrana dañada puede permitir pérdidas de citoplasma. Dado que el contenido de la célula necrosada es perjudicial para el tejido, el organismo responde con una reacción inflamatoria. En cirugía, los métodos mecánico, térmico o láser, pueden provocar la necrosis de la célula. El tejido necrótico es eventualmente eliminado por el organismo, pero la inflamación prolonga el proceso de curación y puede causar complicaciones. El cuerpo reacciona a la inflamación formando un exceso de tejido que puede provocar, por ejemplo, una reducción en el diámetro de las arterias. En otras partes del cuerpo puede dejar una cicatriz. Si como resultado de una cirugía no se tuviese necrosis e inflamación, se tendría sin duda una gran recuperación.
- La apoptosis o muerte celular programada es un mecanismo interno de autodestrucción que es activado por células que pueden, o no, estar dañadas y es peligroso para el tejido. La apoptosis tiene lugar en la morfogénesis del desarrollo, en la renovación natural del tejido, en ADN dañado, en infecciones virales, en células cancerosas, etc. Presumiblemente, ciertos daños irreversibles a las células pueden activar la apoptosis [Al-1994, Co-1997, St-2006]. Los cambios morfológicos en la célula durante la apoptosis son fáciles de reconocer. En el inicio de ésta, el ADN del núcleo se somete a la condensación y fragmentación y la membrana celular muestra una inflamación; posteriormente, la célula se fragmenta en elementos de la membrana. La materia orgánica de la célula es reciclada, ya que los cuerpos apoptóticos con cubiertos por los macrófagos o células vecinas. De este modo, es deseable eliminar células con apoptosis durante la cirugía. La inducción selectiva de la apoptosis puede lograr que un tejido patológico prácticamente desaparezca sin dejar rastro. Dicha cirugía, realizada con una alta precisión, constituye una intervención terapéutica menos destructiva. Se espera que ésta no produzca inflamación, complicaciones en la curación ni formación de estenosis en la cicatrización.
Hay cuatro tipos básicos de célula: epitelial, conectiva, muscular y nerviosa [Fu-1998]. Dentro de los cuatro respectivos tejidos básicos existen varios subtipos que exhiben diferentes fenotipos morfológicos y funcionales. Los tipos de células que serán utilizados en el estudio del proyecto aquí presentado incluyen los fibroblastos, células endoteliales y células de músculo liso.
Los fibroblastos son parte de la familia de tejido conjuntivo, lo que significa que ellos están especializados en la secreción de colágeno en la matriz extracelular (son las células del tejido conectivo, ECM). Esta propiedad es importante tras una lesión en el tejido para contribuir a aislar y reparar el tejido dañado [Al-1994]. Las células epiteliales que componen la superficie interior de los vasos sanguíneos y linfáticos se denominan células endoteliales. Una capa de tejido conectivo se interpone entre el endotelio y el músculo liso subyacente; las propiedades de las células de músculo liso varían según la ubicación de los vasos sanguíneos [Ru-1999].
La ECM tiene en total cinco componentes que conforman un grupo complejo: colágeno, membranas base, fibras elásticas, glicoproteínas estructurales y proteoglicanos [Ru-1999]. La ECM es importante porque ayuda a proteger y apoyar a las células, participa en la transducción de la señal, ayuda a mantener la forma de la célula, y permite el desarrollo de células (crecimiento y migración) [Fu-1998]. Las células interactúan con la ECM a través de las moléculas de adhesión celular
Fuente de plasma biocompatible. ¿Qué hace a un plasma bio-compatible? Depende mucho de lo que uno espera del tratamiento con el plasma. En general, se coincide en que un daño al organismo vivo debería evitarse o al menos reducirse al mínimo. Esto impone un buen número de restricciones a la fuente de plasma, en particular a sus propiedades térmicas, eléctricas y su actividad química (toxicidad). Antes de entrar en detalles sobre las posibilidades y consecuencias de un tratamiento con plasma in vivo, se describirán algunas características básicas de los plasmas atmosféricos y se marcarán los requisitos de seguridad necesarios.
Como se mencionó anteriormente, los plasmas fuera de equilibrio térmico son referidos como plasmas no-térmicos. La temperatura de sus electrones puede ser 100 a 1000 veces mayor que la temperatura de un gas neutro. ¿Es la temperatura del gas siempre lo suficientemente baja como para eliminar completamente el daño térmico?. Esta ha sido siempre una preocupación en el procesamiento de superficies sensibles al calor, como plásticos y telas, pero para los tejidos vivos es obviamente más crucial. Los efectos térmicos fueron estudiados en relación con la cirugía con láser [Ni-1996]. Una temperatura mayor a los 316.15°K (43°C), en la mayoría de los casos causa daño a las células y tejidos. El alcance de este daño depende del tipo de célula o tejido y la duración de la exposición a esas temperaturas. Por ejemplo, un aumento de temperatura de sólo 275.35°K (2.2°C) en la pulpa dental hace que no sólo sea un dolor intenso, sino que también causa necrosis en la pulpa [Za-1965]. Por el contrario, tejidos como la piel pueden soportar la elevación de la temperatura hasta 333.15°K (60°C) durante varios segundos sin daños sustanciales [Be-1980].
Un control riguroso de la temperatura de las moléculas de gas en el plasma y de la temperatura de la superficie de los tejidos expuestos es indispensable, de acuerdo al efecto deseado del tratamiento con plasma. En un tratamiento específico como la cauterización y la coagulación de las heridas, el calentamiento del tejido es una parte de la terapia. En este caso la temperatura no es tan crítica, siempre y cuando no haya carbonización o daño profundo del mismo.
Existen diferentes técnicas para la determinación de los parámetros del plasma y la temperatura en la superficie a ser tratada. Mediante espectroscópica se miden las intensidades relativas de las bandas de rotación (temperatura de rotación). Este es un método para determinar la temperatura del gas cuya precisión es algo limitada. Por ejemplo, a temperaturas cercanas a la ambiente, el error está, en el mejor de los casos, del orden de diez grados [La-2009]. En el contexto general de la física de los plasmas esto no es tan crítico, pero, en la medicina, cada grado por encima de la temperatura corporal puede convertirse en un riesgo. Tanto en biología como en materiales se utilizan a menudo termopares. Esto es debido a que proporcionan información directa sobre el flujo térmico hacia la superficie expuesta.
En la Tabla 1, se muestran algunas fuentes típicas de plasmas no-térmicos y los correspondientes gases utilizados, citándose las temperaturas obtenidas. La mayoría de estos resultados fueron obtenidos mediante métodos espectroscópicos. La tabla 1 contiene los datos de una selección bastante completa de descargas atmosféricas, y se puede concluir que no muchos de estos plasmas son adecuados para el tratamiento de muestras orgánicas.
Tabla 1: Selección de descargas atmosféricas
|
Fuente de plasma |
Tipo |
Gas |
T [°K]/[°C] |
Referencia |
|
Plasma Jet a presión atmosférica (APPJ) |
RF acoplada capacitivamente |
Helio, argón |
400/126.85 |
[Sa-2008] |
|
Resplandor atmosférico |
Resplandor en CA y CD |
Aire |
800-1500/ 526.85-1226.85 |
[Lu-2003] |
|
Plasma de arco jet |
10-40 kHz |
Aire, N2, O2 |
520/246.85 |
[To-2002] |
|
Antorcha de microondas |
2.45 GHz |
Argón + O2 |
2200/1926.85 |
[Sh-2008] |
|
Plasma de CA |
CA |
Helio+O2 |
800-900/ 526.85-626.85 |
[Mo-2003] |
|
DBD |
Barrera dieléctrica |
N2+O2+NO |
300/26.85 |
[Ba-1999] |
|
Pulsada de DBD |
Barrera dieléctrica |
Argón+H2O |
350-450/76.85-176.85 |
[Mo-2000] |
|
Resplandor atmosférico |
Resplandor en CD DC con electrodo de cátodo frío |
Aire |
2000/1726.85 |
[Mo-2002] |
|
Plasma de aguja |
RF acoplado capacitivamente |
Helio+N2 |
350-700/ 73.85-426.85 |
[St-2002 ] |
|
Plasma de aguja |
RF micro-plasma |
Helio+H2O |
300/26.85 |
[St-2006] |
Electricidad y plasma. A presión atmosférica, el voltaje de rompimiento en un gas puede ser bastante alto: desde varios cientos de Volts hasta del orden de los kV, de acuerdo con el tipo de descarga (CD, RF, microondas, etc.), la separación entre los electrodos y la composición del gas. Obviamente, la electricidad representa un peligro. Un relámpago podría ejemplificar su manifestación más impresionante y aterradora. Sin embargo, la mayoría de los fenómenos eléctricos habituales, tales como las chispas en seco, el contacto que se experimenta después de tocar alguna superficie electrificada o la carga eléctrica en cabello y ropa, están lejos de ser destructivas. Los voltajes eléctricos que inducen tales fenómenos pueden ser considerablemente altos; por ejemplo, las chispas se generan cuando la intensidad de campo local es aproximadamente de 3×106 V/m. La razón de su inocuidad se encuentra en una muy baja corriente eléctrica y, en consecuencia, una baja disipación de energía. De este modo, uno puede afirmar en principio que el daño térmico está relacionado más con la corriente eléctrica que con la tensión o el campo eléctrico.
Las aplicaciones de la electricidad no son desconocidas en la medicina. La electrocirugía puede ser el ejemplo más destacado: una potencia eléctrica sustancial es disipada en el tejido vivo, con la coagulación/corte controlados como resultado. También en la mayoría de los equipos médicos avanzados se utiliza la electricidad. La introducción de nuevas técnicas ha motivado estudios a fondo de los efectos de los campos eléctricos y radiaciones electromagnéticas en los seres vivos. En particular, las corrientes alternas (alta frecuencia) que pasan por el cuerpo han atraído una atención considerable. Información al respecto se encuentra en Gabriel et al [Ga-1996] (propiedades dieléctricas y conductividad de los tejidos), Reilly [Re-1992] (estimulación del nervio y músculo) y Polk [Po-2000] (electroporación y otros efectos inducidos por el campo). Estos estudios revelaron que la sensibilidad de los nervios y músculos a la corriente eléctrica decrece conforme se aumenta la frecuencia de trabajo de los equipos. La corriente de umbral que provoca irritación es sólo 1 mA a 10 Hz y de 0.1 mA a 100 kHz. Este resultado es de gran importancia para la electrocirugía y el tratamiento por plasma, esto implica que en las aplicaciones médicas se deben emplear fuentes de alta frecuencia siempre que estén en contacto con el organismo. El límite de seguridad se encuentra alrededor de 100 kHz, así que una gran cantidad de los equipos opera a 300 kHz o más.
La interacción del campo eléctrico con la membrana celular es un tópico de gran interés hoy en día. La muerte de las células debido a la ruptura de la membrana es uno de los peligros relacionados con los campos eléctricos. La electroporación puede ser un efecto secundario no deseado durante el tratamiento con plasma. La ruptura de la membrana celular se produce cuando la diferencia de potencial a través de ésta es del orden de 1 Volt [Po-2000]. Dado que la membrana tiene un espesor de varios nm, el campo eléctrico externo que hace que este daño debe ser del orden de 108 V/m. Los campos eléctricos en los plasmas creados por el hombre son, por lo general, más bajos, del orden de 105-106 V/m. Por otra parte, los campos eléctricos están prácticamente ausentes en las zonas periféricas del plasma que son las involucradas en el tratamiento. De este modo, uno puede afirmar que el tratamiento con plasma no causa daño eléctrico.
En algunos casos, el campo eléctrico puede llegar a ser beneficioso. Los efectos de los transitorios producidos en los campos eléctricos en las células vivas han sido estudiados por diversos investigadores [Sc-2001, Jo-2002, De-2003] siendo la duración del pulso eléctrico entre 60 ns a 100 μs con un campo eléctrico de 3-15×106 V/m. Los autores encontraron las condiciones en que la electroporación en la membrana se vuelve reversible. Por otra parte, aparecen modificaciones notables en el interior de la célula. Pulsos pequeños de campo eléctrico son capaces de inducir muerte programada (apoptosis) en células cancerosas, de modo que se puede usar un plasma con estas características para suprimir el crecimiento del tumor [Be-2002].
Toxicidad por especies reactivas. El plasma es una rica fuente de radicales y otras especies activas. Los radicales libres se han ganado una reputación inexacta en biología y medicina, debido a su capacidad de causar daño a las células dañadas [Ba-1999a], en especial, las ROS (especies reactivas del oxígeno). La familia ROS comprende radicales como O, OH y HO2, aniones de peróxido O2- y HO2-, ozono y peróxido de hidrógeno. Estas especies se crean fácilmente en el aire y el agua, y viven lo suficiente para llegar a la célula y atacar a la materia orgánica. Cuando el nivel de ROS en los fluidos del cuerpo es demasiado alto ocurren varios tipos de daño, conocidos bajo el nombre común de estrés de oxidación. Una alta concentración de los radicales de oxígeno acelera el envejecimiento de las células y tejidos. A nivel celular, se han identificado varios efectos que conducen a la lesión de la célula:
- Peroxidación de lípidos, es decir, la oxidación de los lípidos insaturados en la membrana celular (daño a la membrana),
- Daño del ADN -oxidación de la bases del ADN-, llevando a la rotura de la cadena del ADN,
- Oxidación de proteínas. Generalmente no es tan perjudicial, ya que las proteínas dañadas se reemplazan fácilmente, si bien se puede reducir temporalmente la actividad enzimática.
Sin embargo, los radicales libres también tienen funciones importantes en el cuerpo humano. Pequeñas cantidades de radicales libres son producidos por el propio organismo. Por ejemplo, los macrófagos generan ROS para destruir las bacterias invasoras; las células endoteliales producen óxido nítrico (NO) para regular la dilatación de la arteria. No está completamente claro qué concentraciones de radicales son indispensables para el buen funcionamiento del cuerpo, y en qué grado de exceso son demasiado peligrosos. Debe haber siempre un compromiso entre beneficios y daños, pero los números pueden variar de un individuo a otro. La producción de radicales por el cuerpo durante el ejercicio físico puede aumentar la concentración de ROS en el plasma sanguíneo incluso hasta 0.1 mM [Me-2001].
Radiación aleatoria. Es conocido que la irradiación UV puede causar lesiones en las células [St-2001], por ello es necesario conocer los efectos de las longitudes de onda sobre dichas lesiones. El intervalo de interés puede restringirse a las siguientes tres categorías principales:
- UV-A (315-380 nm) es la zona menos nociva, esta radiación provoca el curtido de la piel pero también puede acelerar su envejecimiento.
- UV-B (280-315 nm) es la zona donde absorbe el ADN y, por lo tanto, donde se provocan daños en éste.
- UV-C (100-280 nm) esta zona es más agresiva que la UV-B pues daña el ADN, proteínas y lípidos celulares. Sin embargo, la radiación por debajo de 150 nm se puede bloquear con agua (con coeficiente de absorción 103-104 cm-1), por lo que el eventual daño puede no ser tan severo.
Giese y Darby [Gi-2000] han determinado que la radiación UV-B y UV-C pueden inactivar eficientemente las bacterias, si bien, en todos sus intervalos, el UV es un factor importante en la esterilización bacteriana por plasmas de baja presión [Ph-2002]. Sin embargo, los plasmas no-térmicos por debajo de la presión atmosférica son, generalmente, pobres fuentes de radiación UV [La-2004]; así, la potencia irradiada en la zona de 200-300 nm es del orden de 1 mW/cm2. La exposición al UV puede acelerar la curación de heridas [Ru-1999], y ésta es un área de oportunidad para el desarrollo del proyecto aquí presentado. En los plasmas atmosféricos se tiene que la radiación UV es de intensidad débil y por lo tanto puede no tener mucho efecto sobre las células y las bacterias. La respuesta específica en las células es probablemente inducida por otros factores, como la química del plasma.
Equipos de cirugía por plasma en la actualidad. Los plasmas se están utilizando cada vez más en las ciencias de la salud, por ejemplo, para el recubrimientos de implantes con capas bio-compatibles [Kl-1994, Ma-2001, Ol-2009, Gr-2009, Mu-2009], esterilización [La-1996, Le-2001], modificación de la superficie de biomateriales con base en polímeros [Sc-2001a, Cr-2010], etc. Sin embargo, estas técnicas no se aplican en vivo: la primera aplicación del plasma en vivo fue la coagulación de sangre por medio de un plasma de argón (APC, por sus siglas en inglés) [Gr-1999] utilizando una sonda flexible de endoscopia. A continuación se presentan tres aplicaciones en vivo de los plasmas: electrocirugía, la coagulación de plasma y la erosión de la chispa.
Electrocirugía. D'Arsonval descubrió en 1893 que la corriente de alta frecuencia que pasa a través del cuerpo no causa estimulación al nervio ni al músculo [http://www.bem.fi/book/01/01.htm]. En la actualidad, la electrocirugía se ha estabilizado en la medicina como un dispositivo de corte eléctrico que sustituye el bisturí en prácticamente cualquier tipo de cirugía. Una lista detallada de las aplicaciones puede encontrarse en la base de datos de ERBE (http://www.erbe-med.de), una empresa líder en producción de equipos para cirugía por medios eléctricos, criogénicos y plasma. Las herramientas electro-quirúrgicas fabricadas por ERBE funcionan con generadores de alta frecuencia en 330 kHz ó 1 MHz. Los dispositivos pueden suministrar potencias del orden de 220-450 W, dependiendo del tipo de aplicación. La potencia puede regularse durante la operación, para obtener la profundidad deseada en la incisión, así como la posibilidad de coagulación local. Esto es especialmente importante para lograr la hemostasia y evitar así la pérdida de sangre, la formación de trombos y la contaminación de los tejidos durante la cirugía. La coagulación eléctrica también se utiliza para sellar los vasos sanguíneos.
Coagulación por plasma. Lo anteriormente descrito se basa en el calentamiento del tejido, y puesto que la corriente eléctrica fluye a través del cuerpo, pequeñísimos daños en el tejido pueden ocurrir. Por lo tanto, la electrocirugía puede no ser aplicable cuando se trabaja con el tejido de manera superficial, en tal caso, el plasma puede ofrecer esa posibilidad.
La desvitalización por el calor, se puede lograr por la exposición a cualquier fuente de calor. El plasma atmosférico generado por una descarga eléctrica de alta potencia es una de las opciones. El objetivo del tratamiento es la coagulación, la detención de la hemorragia y, a veces, incluso la total disecación del tejido.
Una descarga adecuada, desarrollada por ERBE, ha llevado a la técnica quirúrgica llamada coagulación por plasma de argón (APC). Los parámetros de su fuente incluyen una frecuencia de 350 kHz, voltaje de varios kV y potencia de 50 W. En este caso se utiliza un electrodo con una punta de 2 a 10 mm. Dado que el plasma es conductor de la electricidad, la corriente puede fluir a los tejidos, si bien el electrodo no debe tocar el cuerpo. Ésta es una de las ventajas más importantes de APC: la energía se transfiere sin contacto con el cuerpo, por lo que se pueden evitar los riesgos de quemadura del tejido. El APC tiene la capacidad de tratar superficies irregulares y alcanzar cierta profundidad de penetración.
Hasta este momento, no es totalmente claro qué causa la coagulación del tejido tratado. Puede ser el calor transferido directamente desde el gas caliente, así como el calor generado dentro de los tejidos por la disipación de energía de calentamiento. Sin embargo, en el último caso, uno esperaría un calentamiento masivo o, al menos, una mayor profundidad de penetración. El mecanismo físico de coagulación no está completamente resuelto, aunque el dispositivo APC ha sido aplicado con éxito en muchos tipos de cirugía. La aplicación más obvia es la cirugía abierta donde se promueve la hemostasia en las heridas y úlceras sangrantes. Diversas enfermedades de la piel también han sido tratadas con el dispositivo APC [Wa-1997, Wa-1997a, Br-1998, Mo-2001a, Ma-2006, He-2008, Wi-2009, Ta-2010].
Erosión de la chispa . Ésta es una aplicación especial y no convencional de plasma en la cirugía. Con la cual se ha tratado la aterosclerosis, que es una enfermedad inflamatoria crónica donde se acumula una placa de lípidos en el interior de las arterias con la consecuente obstrucción de éstas [Ro-1999]. El tratamiento de la aterosclerosis es, en la mayoría de los casos, la cirugía. Se debe remover la placa de tal manera que se cause el menor daño posible a la arteria, para minimizar la reestenosis.
Slager y colaboradores [Sl-1985] presentaron un concepto que se encuentra entre el tratamiento de electrocirugía y plasma. Esta técnica, llamada erosión de chispa, se basa en la vaporización de una placa por calefacción eléctrica. La herramienta desarrollada por Slager es similar a la del dispositivo monopolar utilizado en APC, pero no utiliza un gas. En su lugar, el electrodo es inmerso directamente en el torrente sanguíneo y se dirige hacia el área afectada. Una corriente alterna (250 kHz) se aplica a la punta del electrodo de manera pulsada, con una duración del impulso de 10ms a voltajes relativamente altos de hasta 1.2 kV. En estas condiciones, el tejido rápidamente es calentado y vaporizado. El vapor producido aísla el electrodo del tejido, de forma que finalmente el tratamiento se realiza efectivamente sin contacto. Después de la vaporización se produce una distribución eléctrica en el vapor y se forma una pequeña chispa <1 mm. La erosión de la chispa permite quitar una cantidad sustancial de placa.
Uno de los principales problemas de utilizar la erosión de la chispa, es la formación de burbujas de vapor, las cuales pueden llevar a una oclusión vascular. Por ello, estos dispositivos son utilizados en cirugías donde la oclusión no presenta riesgos [Ma-1994]. El rendimiento en la incisión es similar al de la electrocirugía, y, al igual que en las técnicas de plasma, el tratamiento es esencialmente sin contacto. En comparación con la coagulación con plasma de argón, los efectos térmicos en la erosión de la chispa son menores. La duración de la chispa en el plasma es mucho menor que el plasma de argón, así que la temperatura del gas es menor y el calentamiento es puntual. Puesto que no hay flujo de gas, no hay calor transferido por convección. Finalmente, la operación pulsada suprime la carga térmica. Resumiendo, la erosión de la chispa es una interesante técnica quirúrgica, que combina las ventajas de la electrocirugía y coagulación inducida por plasma.
Laboratorio de Física de Plasmas del ININ. En la última década, en el Laboratorio de Física de Plasmas del ININ hemos estado realizando investigaciones relacionadas con la aplicación de los plasmas en las siguientes áreas: a) La implantación de iones en aceros inoxidables, titanio y aluminio [Lo-2002, Lo-2003, Lo-2004, Va-2004a, Va-2004b, Lo-2005, Mu-2005, Gr-2006a, Gr-2006b, Lo-2006, Gr-2007a, Gr-2007b, Lo-2007, Va-2007, Va-2008, Gr-2008, Va-2008a, Va-2008b, Pi-2008, Gr-2009, Gr-2009a, Mu-2009, Mi-2009, Va-2010a, Lo-2010, Va-2010b, Mu-2011]; b) La eliminación de microorganismos en líquidos [Ro-2006a, Ro-2006b, Ro-2006c, Ro-2008a, Ro-2008b]; c) El tratamiento de bacterias en medios biológicos y [Pe-2007, Pe-2008, Lo-2008, Pe-2010a, Pe-2010b]; y d) La eliminación de SO2 mediante descarga corona así como NOX y H2S en descarga de barrera dieléctrica [Go-2004, Go-2005, Go-2006a, Go-2006b, Fl-2006a, Fl-2006b, Me-2006, Va-2006, Me-2008a, Me-2008b, Fl-2009, Fl-2009a, Fl-2009b, Va-2009, Fl-2010]. En estas investigaciones se han diseñado, construido y puesto en operación diferentes equipos con los que se llevan a cabo los diferentes tipos de descargas de plasmas, así como los sistemas de diagnóstico y caracterización del plasma.
Dentro de estos equipos, en el Laboratorio de Física de Plasmas recién se ha realizado la instrumentación electrónica como fuente alternativa para generar el plasma frío a presión atmosférica utilizando el concepto de la aguja de plasma [Pe-2006, Pe-2007, Pe-2010a, Pe-2010b]. Con ésta, a la fecha se ha realizado la caracterización de la misma desde el punto de vista eléctrico del plasma generado, y asimismo se ha determinado teórica y experimentalmente la temperatura en las proximidades de la descarga en función de la potencia generada por el equipo. Éste proporciona un voltaje de salida con magnitud suficiente para lograr el voltaje de rompimiento necesario para generar la descarga, y como una aportación a las fuentes generadoras de plasma de RF y lo cual la hace sobresaliente, es el hecho que no es necesario el uso de una red de acoplamiento para generar descargas estables a presión atmosférica. En este momento el equipo está listo para ser aplicado en el campo de la medicina en: a) Tratamiento de la piel en la desinfección, cauterización y cicatrización de heridas, y b) Aplicaciones dentales. Y en un futuro cercano probablemente en el tratamiento de cáncer de piel.
Beneficios:
A la conclusión del proyecto (año 2015) se espera proporcionar un instrumental del tipo aguja de plasma con aplicación en el sector salud. En particular en el tratamiento de las caries dentales y el tratamiento superficial de piel, bien podría ser en heridas, personas con pie diabético y cáncer de piel.
Logros Obtenidos:
Artículos publicados:
a) E. García-Alcántara, R. López-Callejas, R. Peña-Eguiluz, S. Lagunas-Bernabé, R. Valencia-Alvarado, A. Mercado-Cabrera, S. R. Barocio, A. E. Muñoz-Castro, B. G. Rodríguez-Méndez, Aníbal de la Piedad-Beneitez. "Time effect and aliquot concentration in Streptococcus mutans elimination by plasma needle", Journal of Physics: Conference Series 370 (2012) 012018, doi:10.1088/1742-6596/370/1/012018, pp. 1-5.
b) V. E. Quiroz-Velázquez, R. López-Callejas, B. G. Rodríguez-Méndez, R. Peña-Eguiluz, A. de la Piedad-Beneitez, A. E. Muñoz-Castro, S. R. Barocio, A. Mercado-Cabrera, R. Valencia-Alvarado, “Power Supply Instrumentation for Pulsed Dielectric Barrier Discharges”, Journal of Physics: Conference Series 370 (2012) 012064, doi:10.1088/1742-6596/370/1/012064, pp. 1-5.
c) N. Hernández-Arias, B. G. Rodríguez-Méndez, R. López-Callejas, D. Alcántara-Díaz, R. Valencia-Alvarado, A. Mercado-Cabrera, R. Peña-Eguiluz, A. E. Muñoz-Castro, S. R. Barocio, A. de la Piedad Beneitez. “Inactivation of Escherichia coli in Water by Pulsed Dielectric Barrier Discharge in Coaxial Reactor”, Journal of Water and Health 10-3 (2012) 371-379.
Formación de recursos humanos
Victor Eduardo Quiroz Velázquez, Doctorado en Ciencias en Ingeniería Electrónica del Instituto Tecnológico de Toluca con la tesis “Fuentes pulsadas para aplicaciones en plasmas”, Noviembre 2012.
Aplicaciones:
En el sector salud: desarrollo de nuevas técnicas y tratamientos médicos.
Vinculación:
- Universidad Autónoma del Estado de México con el Dr. Salvador Lagunas Bernabé, Dr. Alberto Barbabosa Pliego
- Laboratorio de Biología (ININ) con: Dr. Pedro Rosendo Morales Ramírez, Dr. Jorge Serment Guerrero, M. en C. David Alcántara Díaz,
- Centro de Investigación y Estudios Avanzados en Salud Animal, Facultad de Medicina Veterinaria y Zootecnia con Dr. Raúl Fajardo Muñoz
31/03/2014 por Tonatiuh Rivero Gutiérrez
Proyectos 2012
Actínidos y lantánidos: for...
ALTERNATIVAS PARA ALMACENAM...
Análisis de Reglas Heurísti...
ANÁLISIS POR TÉCNICAS IBA (...
Aplicaciones de los plasmas...
Biopolímeros microporosos s...
Desarrollo de Nanocatalizad...
Desarrollo de sistemas dosi...
Diseño de biomateriales pol...
Diseño de catalizadores uni...
Disminución de gases tóxico...
Dosimetría básica y aplicac...
Efectos del campo eléctrico...
Estudio de los efectos de l...
Estudio para el desarrollo ...
ESTUDIO TEORICO DE REACCION...
EVALUACION DE LA CONTAMINAC...
Evaluación de la reducción ...
EVALUACIÓN DE LOS EFECTOS D...
Evaluación de los Procedimi...
EVALUACION DEL EFECTO GENET...
FORMACIÓN DE ESTRUCTURA DE ...
FUNDAMENTOS EXPERIMENTALES ...
Mecanismos de activación de...
MEJORAMIENTO GENÉTICO DE PL...
MODULACIÓN DE LA RESPUESTA ...
OXIDACION DE TITANIO POR PL...
PREPARACIÓN Y CARACTERIZACI...
PRODUCCION Y CARACTERIZACIO...
Radiofármacos de 99mTc-HYNI...
Reacciones de baja energía ...
INSTITUTO NACIONAL DE INVESTIGACIONES NUCLEARES - ALGUNOS DERECHOS RESERVADOS © 2014 - POLÍTICAS DE PRIVACIDAD
Carretera México-Toluca s/n, La Marquesa Ocoyoacac, México
C.P. 52750 - Tel. +52(55) 53297200
Comentarios sobre este Sitio de Internet

